Gesundheitsforschung in 4D - Data

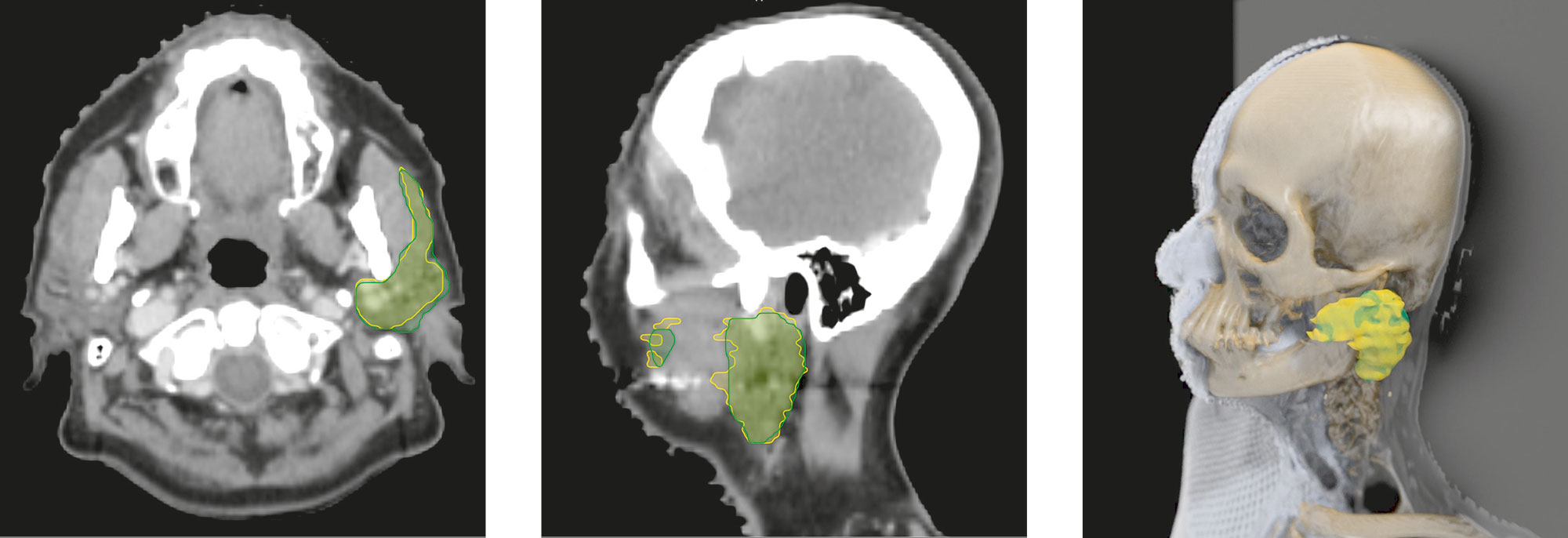
Ein Büro im Fraunhofer-Institut für Bildgestützte Medizin MEVIS in Bremen. Dr. Jan Klein beugt sich über den Rechner und holt per Mausklick ein Bild auf den Monitor – die CT-Aufnahme eines menschlichen Kopfs. »Hinten ist das Kleinhirn, vorn sieht man die Zähne«, erklärt der Informatiker. »Und das, was farbig markiert ist, ist die Ohrspeicheldrüse.« In der Klinik hilft eine solche Markierung, die Strahlentherapie bei Kopf-Hals-Tumoren zu planen: Um Nebenwirkungen wie Mundtrockenheit zu minimieren, soll die Drüse möglichst wenig mitbestrahlt werden.
Auf dem Bildschirm von Jan Klein wird das kleine Organ gleich von zwei Linien umgrenzt: Die gelbe wurde von einem Arzt ins Bild eingetragen. Die grüne hat einen Lernalgorithmus basierend auf einem neuronalen Netzwerk berechnet. Trainiert mithilfe von 450 Referenz-Datensätzen, lernt es ganz von selbst, woran es bestimmte Strukturen in Bildern erkennen kann – mit Erfolg. »Wie Sie sehen, liegen beide Linien dicht beieinander«, sagt Klein. »Oft ist unser Programm sogar besser als ein Arzt, denn im Klinikalltag müssen die Mediziner das Einzeichnen meist unter Zeitdruck erledigen.«
Verknüpfung medizinischer Daten
Diese automatische Segmentierung – das Erkennen und Markieren eines bestimmten Organs in einer Bildaufnahme – ist ein kleiner Teil eines umfassenden Projekts: Mit »QuantMed« schaffen die Fraunhofer-Forscher die technologischen Grundlagen für eine IT-Plattform, die der Medizin wertvolle Dienste leisten soll. Das Ziel: »Wir arbeiten an einer digitalen Infrastruktur, die unterschiedliche medizinische Daten miteinander verbindet«, sagt Institutsleiter Prof. Horst Hahn. »Konkret verknüpfen wir Bilddaten aus MR-Scannern und Röntgengeräten mit anderen klinischen Informationen, etwa mit Blutwerten, genetischen Daten und digitalisierten Gewebeschnitten.«
Diese komplexen, miteinander verwobenen Datensätze werden dann von lernfähigen Programmen, den Deep-Learning-Algorithmen, nach aussagekräftigen Mustern durchforstet. Die Ergebnisse dieser Analysen sollen die Ärzte gleich in mehrfacher Hinsicht unterstützen – etwa bei der Identifikation einer Hirnblutung, bei der patientenschonenden Tumorbestrahlung und bei der Frage, welches Medikament für eine Chemotherapie das aussichtsreichste sei. Die Fachleute sprechen von »Radiomics«: Die computergestützte Kombination von Bildaufnahmen und klinischen Daten soll helfen, den Therapieerfolg genauer vorhersagen zu können.
Gehirnblutungen automatisch erkennen
Basis der neuen Technologie sind einzelne Knotenpunkte, die »Knowledge Nodes«, die wertvolle Informationen aus den Datensätzen ableiten können. »Ein solcher Knoten kann zum Beispiel in einer Klinik stehen«, beschreibt Klein. »Unsere Lernalgorithmen arbeiten vollkommen autonom, sodass keine sensiblen Patientendaten nach außen gelangen.«
Dennoch können sich verschiedene Nodes über einen »Hub« austauschen – einen Rechenknoten, der das Lernalgorithmus-Wissen aus mehreren Kliniken validiert, kombiniert und verbessert. »Dadurch ließe sich beispielsweise das automatische Erkennen und Klassifizieren von Gehirnblutungen auf CT-Bildern optimieren«, erläutert Klein. »Für den Arzt wäre das eine Erleichterung, er muss diese zeitraubende Aufgabe nicht mehr selbst erledigen, sondern nur noch das Resultat des Computers überprüfen.« QuantMed startete im Oktober 2016. Beteiligt sind Kliniken, Klinikverbünde, eine Fachgesellschaft und Unternehmen. »Zur Halbzeit des Projekts ist die erste Version des Systems fertig, jetzt gehen wir in den Testbetrieb«, sagt Hahn. »Am Ende soll eine einsatzfähige Infrastruktur stehen, mit der Kliniken und Forschungseinrichtungen routinemäßig neues Wissen aus großen Datenmengen ableiten können.«
Weitere Informationen
Maschinelles Lernen hilft Medizinern
Um anhand von Bildaufnahmen zu prüfen, wie sich ein Tumor im Laufe einer Krebstherapie entwickelt, sind Ärzte bislang vor allem auf ihr Augenmaß angewiesen. Ein neues Programmpaket von Fraunhofer-Forschern macht Veränderungen in den Bildern sichtbar und erleichtert Medizinern die Arbeit mittels Deep Learning.
Algorithmen für die Leberchirurgie – weltweit sicherer operieren
Die Leber durchlaufen vier komplex verwobene Gefäßsysteme. Die chirurgische Entfernung von Tumoren ist daher oft eine schwierige Aufgabe. Das Fraunhofer-Institut für Bildgestützte Medizin MEVIS hat Algorithmen entwickelt, die die Bilddaten von Patienten analysieren und chirurgische Risiken berechnen. Leberkrebsoperationen werden damit besser planbar und sicherer.